Dãy điện hóa của kim loại là phần nội dung kiến thức quan trọng của hóa học vô cơ mà bất kỳ học sinh nào cũng phải nắm được để áp dụng vào làm bài tập. Đây cũng là môn học gây nhiều khó khăn nhất cho học sinh chính vì vậy mà nhiều phụ huynh đã thuê gia sư dạy kèm tại nhà giúp con học tập ngày càng tiến bộ hơn.
Dãy điện hóa chính là dãy hoạt động hóa học của kim loại có ý nghĩa, vai trò quan trọng trong sự phát triển của lĩnh vực hóa học. Bạn cần biết về định nghĩa, tính chất hóa học và ý nghĩa của dãy điện hóa sẽ có trong các tiểu mục dưới đây.

Dãy điện hóa hay dãy hoạt động hóa học của các kim loại là một dãy được sắp xếp theo một thứ tự nhất định có quy luật của các kim loại. Quy luật sắp xếp thứ tự kim loại phụ thuộc vào mức độ hoạt động của từng kim loại. Mức độ hoạt động của kim loại sẽ xác định dựa trên khả năng tham gia phản ứng hóa học của kim loại với các chất khác.
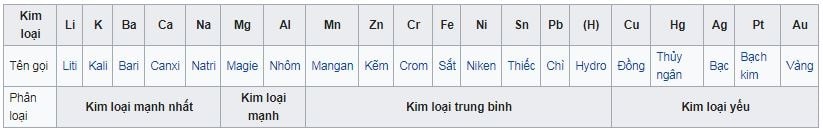
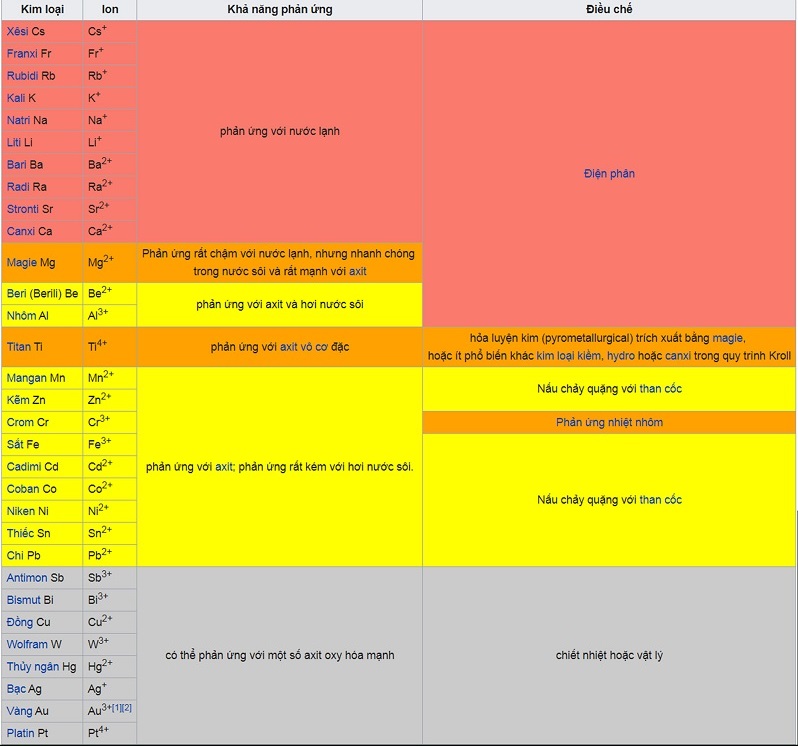
(Bảng tham khảo nguồn: wikipedia)
• Kim loại được sắp xếp theo chiều giảm dần mức độ phản ứng hóa học của kim loại.
• Dãy hoạt động hóa học của kim loại
Ghi chú:
• Chiều sắp xếp kim loại đi từ dưới lên trên cùng của bảng:
• Khả năng bị oxy hóa cao hơn tạo thành các ion +
• Khả năng ăn mòn và xỉn màu dễ hơn
• Khả năng phản ứng tăng
• Khả năng trở thành chất khử mạnh hơn
• Cần nhiều năng lượng hơn kèm theo các phương pháp khác nhau để tách kim loại từ hợp chất.
Như vậy, bạn đã biết về định nghĩa dãy điện hóa và những tính chất cơ bản của chúng.
Xem thêm: Tổng hợp các công thức hóa học cơ bản cần phải nhớ
Để hiểu hơn về các kim loại trong bảng điện hóa, bạn cần biết về tính chất hóa học của kim loại. Kim loại có các tính chất như tính dẻo, tính dẫn nhiệt, tính dẫn điện đồng thời mỗi kim loại lại có khối lượng riêng cùng nhiệt độ nóng chảy, tính cứng khác nhau. Còn sau đây là những tính chất hóa học của kim loại mà bạn cần biết:
• Tác dụng với phi kim
Hầu hết kim loại trong bảng đều tác dụng được với phi kim: 4Al+3O2→t02Al2O3
• Tác dụng với axit
Tác dụng với các dung dịch HCl, H2SO4 loãng: là các kim loại trong dãy điện hóa đứng trước hidro tạo ra hidro. Ví dụ: Zn+H2SO4→ZnSO4+H2
Tác dụng với các dung dịch H2SO4, HNO3 đặc nóng là hầu hết các kim loại chỉ trừ kim loại Au, Pt. Phản ứng xảy ra sẽ khử N+5 và S+6 trong axit xuống mức oxy hóa thấp hơn là N+4(NO2), N+2(NO), N+1(N2O), N0(N2), S+4(SO2), S0, S−2(H2S)
• Tác dụng với dung dịch muối
Trong dung dịch muối, kim loại mạnh hơn sẽ đẩy được kim loại kém hơn thành kim loại tự do. Ví dụ: Fe0+Cu+2SO4→Fe+2SO4+Cu0
• Tác dụng với nước
Các kim loại mạnh và trung bình sẽ khử được nước ở điều kiện nhiệt độ cao hoặc nhiệt độ thường. Ví dụ:
2Na+2H2O→2NaOH+H2
3Fe+4H2O→t0Fe3O4+4H2
Còn những kim loại yếu như Ag, Cu, Hg… không khử được nước kể cả trong điều kiện nhiệt độ cao.
Như vậy, kim loại có nhiều tính chất hóa học mà bạn cần nhớ để có thể áp dụng vào làm các bài tập hoặc thực hành.
Xem thêm: Những điều cần biết về bảng tính tan trong môn hóa học
Nhìn vào dãy điện hóa, chúng ta có thể biết được những gì thể hiện trong đó? Đó là ý nghĩa của dạy điện hóa trong lĩnh vực hóa học mà người học cần nắm được. Cụ thể trong dãy điện hóa của kim loại, ta có thể nhận ra những kim loại nào có thể tác dụng được với nhau, những kim loại nào thì không. Đó chính là quy tắc phản ứng α. Quy tắc phản ứng này diễn ra như sau:

• Các kim loại ở bên phải phía trên của dãy hoạt động hóa học có thể tác dụng với các kim loại ở phía dưới bên trái vì kim loại ở phía trên bên phải mạnh hơn so với các kim loại ở bên trái phía dưới. Như vậy, phải ứng hóa học này chính là phản ứng của kim loại mạnh hơn đẩy các kim loại yếu hơn trong muối ra.
• Các kim loại đứng phía trước có tính khử mạnh hơn những kim loại đứng sau nó. Còn các kim loại đứng sau sẽ có tính oxi hóa mạnh hơn so với các kim loại đứng trước. Ví dụ: Cu2+ + Fe → Fe2 + Cu (kết tủa) theo quy tắc phản ứng α.
Tuy nhiên, có những trường hợp ngoại lệ trong quy tắc α như:
• Kim loại kiềm ở đầu dãy điện hóa không có khả năng khử kim loại mà sẽ có tính năng khử nước. Ví dụ: Ca + 2H2O → Ca(OH)2 + H2
• Những kim loại tính từ Mg đến trước Hidro tác dụng với các dung dịch axite sẽ sinh ra muối và giải phóng khí Hidro. Ví dụ: Zn+2HCl→ZnCl2+H2
• Những kim loại Al, Fe, Cr không phản ứng với axit Nitric HNO3 đặc nguội và axit Sulfuric H2SO4 đặc nguội.
• Những kim loại đứng ở cuối dãy điện hóa như Pt, Au,… sẽ không tác dụng được với axit. Nhờ đó, bạn có thể kiểm tra vàng qua cách thả vào axit.
Như vậy, ý nghĩa của dãy điện hóa học của các kim loại sẽ cho chúng ta biết đầy đủ tính khử của các chất và tính chất oxi hóa của chúng.
Xem thêm: 12 Cách cân Bằng Phương Trình Hóa Học Chuẩn Nhất
Với dãy điện hóa của kim loại, ta có thể áp dụng vào làm các bài tập hóa học, cung cấp cho chúng ta những thông tin hóa học của các kim loại đầy đủ. Đây là phần nội dung kiến thức rất quan trọng trong hóa học vô cơ. Phải nắm được kiến thức này, bạn mới có thể học tốt chương hóa học vô cơ cũng như học giỏi hóa được. Tuy nhiên, việc hiểu dãy điện hóa là điều cần thiết nhưng bạn cũng cấn học thuộc dãy điện hóa kim loại đầy đủ tương đối dài và phức tạp. Giống như khi học bảng hóa trị hay bảng nguyên tử khối, một trong những cách học thuộc, nhớ lâu dãy điện hóa được các bạn học sinh áp dụng là học thuộc bằng cách biến tấu thành một đoạn thơ.
Ví dụ:
Như vậy, bạn hãy gom những kim loại gần nhau thành một nhóm và biến tấu thành đoạn thơ nào mà mình dễ thuộc để học sẽ dễ nhớ hơn rất nhiều.

Sau đây là một số bài tập áp dụng dãy điện hóa để bạn thực hành, có nhiều dạng bài tập khác nhau để các bạn học sinh luyện tập. Việc luyện tập rất quan trọng có thể giúp bạn nhớ được dãy điện hóa cũng như áp dụng những kiến thức đó vào làm bài tập thành thạo.
Bài 1: Muối Fe2+ trong môi trường axit đã làm mất màu dung dịch KMnO4 tạo ra ion Fe3+. Còn ion Fe3+ tác dụng với tạo ra I2 và Fe2+ Bạn hãy sắp xếp các chất oxi hóa Fe3+, I2 và MnO4— theo thứ tự mạnh dần.
A. Fe3+ < I2 < MnO4— . B. I2 < MnO4— < Fe3+.
C. I2 < MnO4— < Fe3+ . D. MnO4— < Fe3+ < I2 .
Bài 2: Cho 4 phản ứng sau đây, bạn cho biết phản ứng nào chứng tỏ Fe2+ có tính khử yếu hơn so với Cu?
A. Fe + Cu2+ → Fe2+ + Cu . B. Fe2+ + Cu → Cu2+ + Fe.
C. 2Fe3+ + Cu → 2Fe2+ + Cu2+. D. Cu2+ + 2Fe2+ → 2Fe3+ + Cu.
Ghi chú: (Đáp án: Bài 1: B, Bài 2: C)
Ngoài ra, bạn có thể tự tìm cho mình các dạng bài tập khác về dãy điện hóa và giải để luyện tập nhiều hơn giúp ghi nhớ tốt các kiến thức đã học mà không chỉ học những thông tin khô khan khó thuộc, khó nhớ.
Để có thể nắm chắc và áp dụng nhuần nhuyễn kiến thức về dãy điện hóa, bạn cần nắm được những kiến thức cơ bản sau đó tìm hiểu thêm để tham khảo cũng như luyện tập nhiều sẽ tốt hơn trong quá trình học.
Để giúp đỡ học sinh học hóa tốt hơn, hiện nay nhiều bạn sinh viên đã đăng ký dạy gia sư phụ đạo cho các em với giáo trình được biên soạn từ kinh nghiệm giảng dạy lâu năm.
Hy vọng những thông tin về dãy điện hóa ở trên có thể giúp bạn dễ hiểu bài, nắm kiến thức tốt hơn về môn hóa trong phần hóa vô cơ này. Chúc bạn thành công!
>> Đọc bài tiếp:




Chia sẻ